
domingo, 20 de noviembre de 2011
TiPoS De @Lc@NoS
Los alcanos son hidrocarburos que sólo contienen enlaces sencillos. Se clasifican en alcanos lineales, ramificados, cíclicos y policíclicos.


domingo, 6 de noviembre de 2011
iSóMeRoS CoNfOrMaCiOnAlEs
Los enlaces simples entre átomos tienen simetría cilíndrica y permiten la rotación de los grupos que unen. Las diferentes disposiciones espaciales que adoptan los átomos como consecuencia de la rotación en torno al enlace se llaman conformaciones. Una conformación concreta de las múltiples posibles se denomina confórmero. 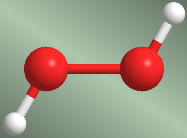
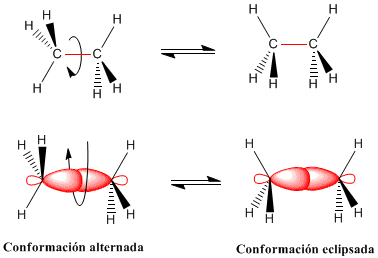
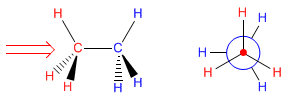
La rotación del enlace carbono-carbono en el etano da lugar a dos conformaciones límite -la conformaciones alternada (con los hidrógenos alternados) y la conformación eclipsada (con los hidrógenos enfrentados-. El paso de la conformación alternada a la eclipsada o viceversa se realiza por giro de 60º. Obsérvese que en un giro de 360º existen infinitas conformaciones posibles.
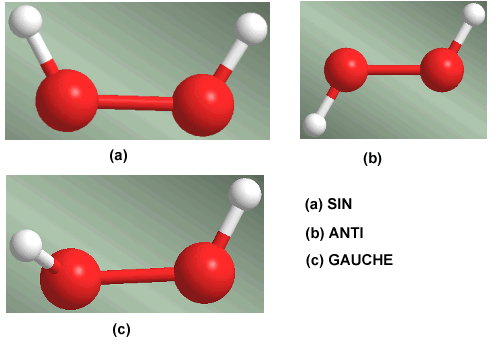
La rotación en torno al enlace simple oxígeno-oxígeno en la molécula de agua oxigenada genera tres conformaciones de especial importancia. La conformación que tiene los hidrógenos enfrentados se llama SIN. Cuando los hidrógenos se sitúan a lados opuestos se habla de confórmero ANTI. La conformación que deja los hidrógenos a 60º recibe el nombre de Gauche.

Conformación anti - agua oxigenada
La rotación del enlace carbono-carbono en el etano da lugar a dos conformaciones límite -la conformaciones alternada (con los hidrógenos alternados) y la conformación eclipsada (con los hidrógenos enfrentados-. El paso de la conformación alternada a la eclipsada o viceversa se realiza por giro de 60º. Obsérvese que en un giro de 360º existen infinitas conformaciones posibles.

Conformaciones del etano
La rotación en torno al enlace simple oxígeno-oxígeno en la molécula de agua oxigenada genera tres conformaciones de especial importancia. La conformación que tiene los hidrógenos enfrentados se llama SIN. Cuando los hidrógenos se sitúan a lados opuestos se habla de confórmero ANTI. La conformación que deja los hidrógenos a 60º recibe el nombre de Gauche.

Isómeros conformacionales del agua oxigenada
ProyEcciÓN de NeWmAn
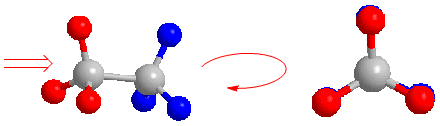
La proyección de Newman se obtiene al mirar la molécula a lo largo del eje C-C. El carbono frontal se representa por un punto, del que parten los tres enlaces que lo unen a los sustituyentes. El carbono de atrás se representa por un círculo y los enlaces que salen de este carbono se dibujan a partir de este círculo.
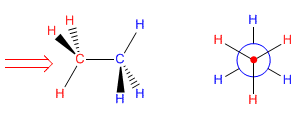
Proyección de Newman del etano
A continuación dibujaremos la proyección de Newman del etano alternado. Miramos la molécula situándonos en la posición de la flecha. Representamos el carbono que tenemos enfrente por un punto y sacamos los enlaces que parten hacia los hidrógenos. El carbono que está al fondo no podemos verlo, aunque si vemos los hidrógenos que parten de él (representados en rojo). Lo representamos por un círculo y sacamos los enlaces que lo unen a los hidrógenos (representados en azul).

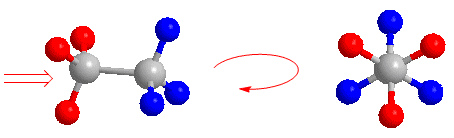
Ahora intentemos proyectar la conformación del etano que tiene todos los hidrógenos enfrentados (llamada conformación eclipsada). Situándonos en la posición de la flecha tenemos enfrente el carbono con los hidrógenos rojos. Los hidrógenos azules quedan tapados y no podemos verlos. En la proyección de Newman estos hidrógenos (azules) aparecen ligeramente girados para poder representarlos.
PrOpIeDaDeS FÍsICaS De lOs @lC@NoS
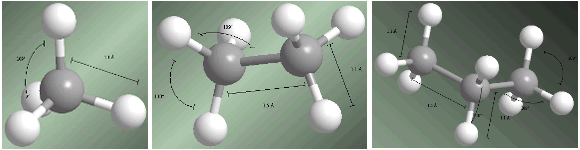
Los alcanos son compuestos con hibridación sp3 en todos sus carbonos. Los cuatro sustituyentes que parten de cada carbono se disponen hacia los vértices un tetraedro.
Las distancias y ángulos de enlace se muestran en los siguientes modelos.
Los alcanos de menor tamaño, metano, etano, propano y butano son gases a temperatura ambiente. Los alcanos lineales desde C5H12 hasta C17H36 son líquidos. Alcanos de mayor número de carbonos son sólidos a temperatura ambiente.
Los puntos de fusión y ebullición de los alcanos aumentan con el número de carbonos de la molécula. También se observa que los alcanos ramificados presentan un punto de ebullición menor que sus isómeros lineales.
En la siguiente gráfica se representan los puntos de ebullición de alcanos lineales (en negro) y los correspondientes a sus 2-metilalcanos isómeros (en azul).
Las distancias y ángulos de enlace se muestran en los siguientes modelos.

Los alcanos de menor tamaño, metano, etano, propano y butano son gases a temperatura ambiente. Los alcanos lineales desde C5H12 hasta C17H36 son líquidos. Alcanos de mayor número de carbonos son sólidos a temperatura ambiente.
Los puntos de fusión y ebullición de los alcanos aumentan con el número de carbonos de la molécula. También se observa que los alcanos ramificados presentan un punto de ebullición menor que sus isómeros lineales.
En la siguiente gráfica se representan los puntos de ebullición de alcanos lineales (en negro) y los correspondientes a sus 2-metilalcanos isómeros (en azul).
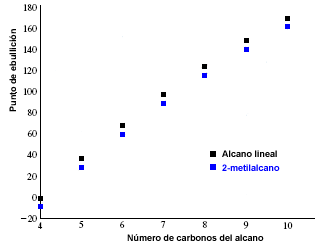
Puntos de fusión y ebullición de alcanos
En fase líquida existen fuerzas de atracción entre moléculas que las mantiene unidas. Para pasar a fase gas la sustancia es necesario vencer estas fuerzas intermoleculares mediante el aporte de energía.
En moléculas neutras, como son los alcanos, las fuerzas atractivas son debidas a interacciones de van der Waals que pueden ser de tres tipos: interacciones dipolo – dipolo, dipolo – dipolo inducido y dipolo inducido – dipolo inducido.
La formación de los dipolos inducidos que producen la atracción entre moléculas neutras puede verse en el siguiente esquema:
La formación de los dipolos inducidos que producen la atracción entre moléculas neutras puede verse en el siguiente esquema:
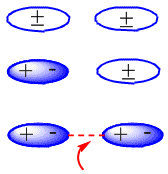
interacción dipolo inducido - dipolo inducido
Consideremos los isómeros del pentano, como ejemplo de la disminución en el punto de ebullición, al pasar de alcanos lineales a ramificados.
El pentano tiene una importante área superficial que permite gran número de interacciones dipolo inducido – dipolo inducido. El 2-Metilbutano es más compacto y posee menor área superficial, menos interacciones intermoleculares y menor punto de ebullición.
CONDUCTIVIDAD
Los alcanos son malos conductores de la electricidad y no se polarizan sustancialmente por un campo eléctrico.
SOLUBILIDAD EN AGUA
No forman enlaces de hidrógeno y son insolubles en solventes polares como el agua. Puesto que los enlaces de hidrógeno entre las moléculas individuales de agua están apartados de una molécula de alcano, la coexistencia de un alcano y agua conduce a un incremento en el orden molecular (reducción de entropía). Como no hay enlaces significativos entre las moléculas de agua y las moléculas de alcano, la segunda ley de la termodinámica sugiere que esta reducción en la entropía se minimizaría al minimizar el contacto entre el alcano y el agua: se dice que los alcanos son hidrofóbicos (repelen el agua).
DENSIDAD
La densidad de los alcanos suele aumentar conforme aumenta el número de átomos de carbono, pero permanece inferior a la del agua. En consecuencia, los alcanos forman la capa superior en una mezcla de alcano-agua.
El pentano tiene una importante área superficial que permite gran número de interacciones dipolo inducido – dipolo inducido. El 2-Metilbutano es más compacto y posee menor área superficial, menos interacciones intermoleculares y menor punto de ebullición.
CONDUCTIVIDAD
Los alcanos son malos conductores de la electricidad y no se polarizan sustancialmente por un campo eléctrico.
SOLUBILIDAD EN AGUA
No forman enlaces de hidrógeno y son insolubles en solventes polares como el agua. Puesto que los enlaces de hidrógeno entre las moléculas individuales de agua están apartados de una molécula de alcano, la coexistencia de un alcano y agua conduce a un incremento en el orden molecular (reducción de entropía). Como no hay enlaces significativos entre las moléculas de agua y las moléculas de alcano, la segunda ley de la termodinámica sugiere que esta reducción en la entropía se minimizaría al minimizar el contacto entre el alcano y el agua: se dice que los alcanos son hidrofóbicos (repelen el agua).
DENSIDAD
La densidad de los alcanos suele aumentar conforme aumenta el número de átomos de carbono, pero permanece inferior a la del agua. En consecuencia, los alcanos forman la capa superior en una mezcla de alcano-agua.
Suscribirse a:
Entradas (Atom)